Van Der Waals
(Dipolo)
As forças de Van Der Waals
De qualquer forma, as abordagens a seguir serão úteis para ambos os casos.
Momento de Dipolo
Essas regiões podem ser caracterizadas por uma parte positiva (onde a nuvem eletrônica é menos densa) e uma negativa (onde é mais densa), assim, um vetor pode ser utilizado para representar a diferença de potencial entre esses dois pontos: o vetor nasce no polo positivo e é direcionado para o negativo.
A molécula é dita polar quando a soma desses vetores produz um vetor resultante de módulo diferente de zero; o contrário vale para uma molécula apolar, onde a soma dos vetores de cada região (delimitada por dois átomos ligantes entre si) resulta num vetor cujo módulo é igual a zero.
Interações Intermoleculares
Dipolo-dipolo
Interações desse tipo são características de substâncias constituídas por moléculas polares, onde o pólo positivo de uma molécula liga-se com o pólo negativo de outra. Assim repetindo-se indefinidas vezes.Dipolo-dipolo induzido
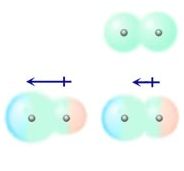
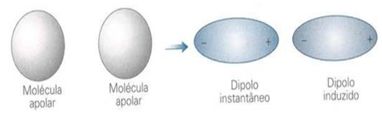
As interações dipolo permanente – dipolo induzido são observadas quando uma molécula polar deforma a nuvem eletrônica de uma molécula apolar. Assim, induz a formação de um dipolo.Dipolo instantâneo – dipolo induzido
Ou seja, em moléculas apolares, há possibilidade de tornar-se polar durante um curto período de tempo. Entretanto, esse tempo é o bastante para que deforme a nuvem de outra molécula apolar e induza-a, de modo a formar dois pólos distintos (positivo e negativo). Tendo assim um dipolo induzido.
Como a molécula de iodo é bem maior que a de flúor, é mais facilmente polarizável, assim, mesmo que as duas sejam apolares, as interações dipolo instantâneo – dipolo induzido são mais intensas na primeira substância.




Nenhum comentário:
Postar um comentário